ללא נוגדנים וללא הגברה: זיהוי מהיר של חלבונים שלמים בטכנולוגיה שפותחה בטכניון
הטכנולוגיה החלוצית, המציגה קפיצת דרך לקראת אבחון מהיר של סרטן ומחלות אחרות, פותחה במעבדתו של פרופ' עמית מלר מהפקולטה להנדסה ביו-רפואית
מאמר דעה שפורסם בכתב העת Nature בשנת 2023 סקר את שבע הטכנולוגיות החשובות ביותר שראוי לעקוב אחריהן, והראשונה ברשימה: ריצוף מולקולת חלבון בודדת. במאמר הודגשה תרומתה המרכזית של קבוצת המחקר של פרופ’ עמית מלר מהטכניון בשיפור הטכנולוגיות הרלוונטיות לקראת מסחור של מערכות ריצוף חלבונים ומהפכה ממשית במחקר הביולוגי והרפואי.
כעת, במאמר בכתב העת היוקרתי Nature Nanotechnology, מציג פרופ’ מלר קפיצת דרך בנושא זה. מאחר שחלבונים הם אבני הבניין של הגוף, זיהויים המהיר והמדויק חיוני להבנה של רוב התהליכים הפיזיולוגיים בגוף האדם, לאבחון מוקדם של מחלות ולהתאמה נכונה של הטיפול הרפואי.

פרופ’ מלר, שהוביל את המחקר עם הפוסט-דוקטורנט ד”ר ניראג’ סוני, הוא חבר סגל בפקולטה להנדסה ביו-רפואית ובפקולטה לביולוגיה וחבר במכון ראסל ברי לננוטכנולוגיה בטכניון. במחקר השתתפו חוקרים מאוניברסיטת אילינוי ומאוניברסיטת רייס.

הטכנולוגיה המוצגת במאמר ב-Nature Nanotechnology מיישמת את הגישה הייחודית שפיתח פרופ’ מלר – מיפוי מולקולות ביולוגיות באמצעות חרירים ננומטריים סינתטיים שמיוצרים בטכנולוגיות ננו מתקדמות – לטובת זיהוי “טביעת האצבע” של חלבונים שלמים. כיום כבר קיימות שיטות לזיהוי חלבונים תוך העברתם בננו-חרירים, אולם כדי להשיג זיהוי ברמת החלבון הבודד נדרשים החוקרים להשתמש בנוגדנים או במנועים מולקולרים מסובכים כדי להאט את תנועת החלבון בחריר – תהליכים שמסבכים ומייקרים את התהליך.
הטכנולוגיה שפיתח פרופ’ מלר מפשטת את התהליך האמור וכן מייצרת תנועה מבוקרת של החלבון בתוך החריר – תנועה של stick–slip, כלומר הדבקה והחלקה. בתהליך זה מודדת המערכת את זרם החלקיקים (יונים) בחריר וכך מספקת את טביעת האצבע הייחודית לחלבונים ספציפיים. שימוש במודל למידת מכונה (ML) מאפשר זיהוי של החלבון מתוך חתימת הזרם במהירות שעולה בכמה סדרי גודל על טכניקות אחרות. מעבר בודד של חלבון לוקח שבריר שנייה, והזיהוי מתרחש כמעט בזמן אמת. המערכת מאפשרת ספירה דיגיטלית של החלבונים בדגימה ואת קטלוגם.
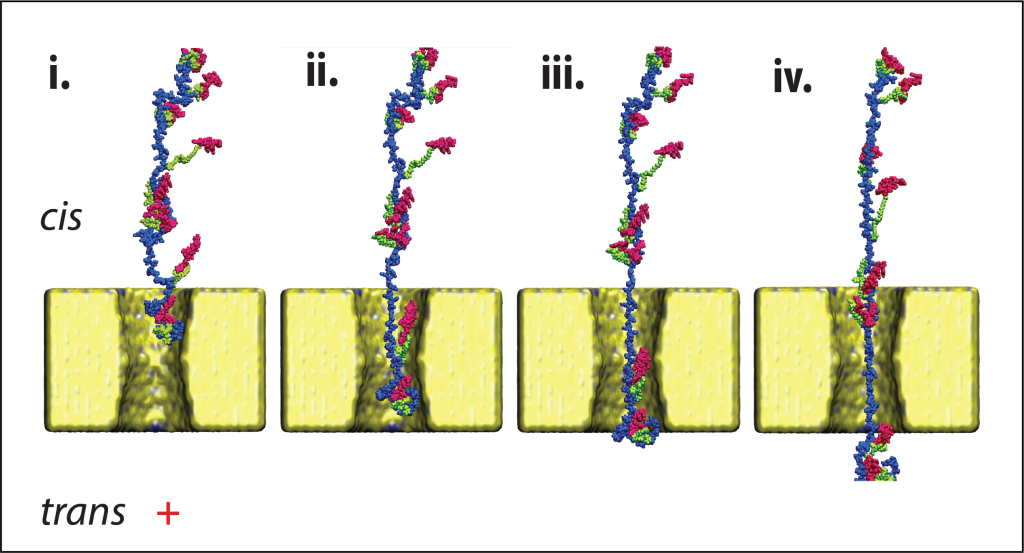
המחקר התמקד בחומצה אמינית בשם ציסטאין [cysteine], החיונית לרבים מן התפקודים הפיזיולוגיים בתא ובגוף כולו. מאחר שכ-97% מהחלבונים בגוף האדם מכילים ציסטאין או שרידי ציסטאין, הגישה ישימה כמעט לכל מכלול הפרוטאום (כלל החלבונים). בנוסף, הטכנולוגיה אינה מוגבלת לחומצה אמינית ספציפית, ובמעבדה כבר עובדים על הרחבתה למספר רב של חומצות אמיניות, לרבות כאלה שעברו שינויים אחרי התרגום (PTMs).
לשיטה החדשה יישומים רבים ומגוונים בהיבט הקליני, ובהם אבחון סרטן והתאמת טיפול מדויק על סמך בדיקות פשוטות דוגמת בדיקות דם. בהיבט המדעי היא צפויה לקדם את התחום של חקר חלבונים, תוך הרחבת הישימות שלה למכלול רחב של חלבונים. לדברי פרופ’ מלר, הרעיון העתידי הוא לפתח פלטפורמה משולבת שתשמש לאבחון מהיר של חלבונים בבתי חולים, במעבדות ובמחקר קליני.
המחקר נתמך על ידי הנציבות האירופית למחקר (ADG-ERC במסגרת תוכנית Horizon 2020).
למאמר ב-Nature Nanotechnology – לחצו כאן



