זיהוי מנגנון החלבונים בהתפתחות מחלת האלצהיימר
גילויים חדשים בהתפתחות מחלת אלצהיימר במחקר בהובלת פרופ' מיכאל גליקמן וד"ר ענבל מניב מהפקולטה לביולוגיה בטכניון התפרסם ב-Nature Communications.
מחלת אלצהיימר קיבלה את שמה מהחוקר הגרמני אלואיז אלצהיימר, שתיאר אותה לראשונה בשנת 1906. המחלה מאופיינת בניוון ובתמותה של תאי עצב, תהליכים המובילים לפגיעה הדרגתית ביכולותיו הקוגניטיביות של הפרט. היא אופיינית למבוגרים מעל גיל 65, אולם ישנם מקרים לא רבים שמועברים בתורשה ופוגעים בחולים צעירים יותר.
כיום נהוג לחלק את מחלות אלצהיימר לשני סוגים – משפחתי ואקראי (ספורדי). מחלת אלצהיימר המשפחתית היא מחלה נדירה (אחוזים בודדים מכלל חולי האלצהיימר) הנובעת ממוטציות גנטיות תורשתיות. מחלת אלצהיימר האקראית, שהיא כאמור הנפוצה יותר, ברורה פחות מבחינת המנגנון, והיא שעמדה בלב מחקרם של ד”ר מניב ופרופ’ גליקמן.
במוחות של חולי אלצהיימר מצטברים חלבונים רעילים. בחולי האלצהיימר המשפחתי, מנגנון ההצטברות ברור היות וישנו קשר נסיבתי בין המוטציות לבין זהות החלבונים הפגומים. במחלה האקראית, לעומת זאת, סיבת הצטברות החלבונים הפגומים אינה ידועה.
כמומחים בחקר חלבונים, חוקרי הטכניון העלו סברה כי הצטברות החלבונים הרעילים במוח נובע משיבוש במערכת פינוי החלבונים – הידועה גם כמערכת האוביקוויטין. הם פיתחו מערכת מודל מתאי עצב אנושיים, המאפשרת לבחון את מעורבותה של מערכת האוביקוויטין בהתפתחות המחלה. במאמר מתוארים ממצאים מהמערכת הזאת, המצביעים על כך שפגיעה במערכת האוביקוויטין בתאי עצב בריאים גורמת להצטברות החלבונים הרעילים באופן המדמה את הפתולוגיה האופיינית למחלה במוח.
החוקרים לא הסתפקו בפענוח גורם ההצטברות, אלא גם בחנו את התזה שלהם על ידי תיקון הנזק באמצעות מולקולת RNA שהם הינדסו לטובת השתקה מכוונת של אחד ממרכיבי מערכת האוביקוויטין. לשמחתם, הטיפול באמצעות מולקולה זו שיפר את מצבם של תאי העצב במערכת. צוות המחקר מציע שמולקולת RNA זו תשמש כאבטיפוס לפיתוח טיפולים יעילים למניעת תסמיני אלצהיימר ואולי אפילו לטיפול בחולים.
בשנים האחרונות חלה התקדמות משמעותית באריזת מולקולות RNA ואספקתם למטופלים. החוקרים מקווים ומעריכים כי עם שינויים קלים בהרכב ואריזה מתאימה תוכל מולקולת RNA זו להניב תוצאות מבטיחות בסביבה קלינית. גילוייהם של חוקרי הטכניון מבהירים את חשיבותה של מערכת האוביקוויטין במניעת אלצהיימר ואת הקשר בין שיבוש במערכת זו להתפתחות המחלה.
חוקרי הטכניון מעריכים כי מעבר לממצאים המוצגים במאמר, הפלטפורמה שפיתחו עשויה לשמש לסריקת תרופות לטיפול או למניעת אלצהיימר אקראי. הם מוסיפים כי פלטפורמה זו תסייע בצמצום הניסויים בבעלי חיים בפיתוח טיפולים חדשים למחלה.
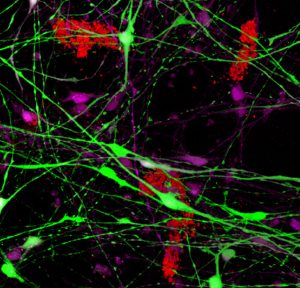
תמונה מדעית. מערכת מודל תלת-ממדית של תאי עצב אנושיים בצלחת. בירוק ובסגול: תאי עצב המבטאים חלבון תקול במערכת האוביקוויטין. כתוצאה מביטוי זה נוצרת הפתולוגיה המאפיינת חולי אלצהיימר – היווצרות צבירי עמילואידים (באדום) מחוץ לתאים
במחקר השתתפו מחאסן סרג’י, אנואר בדרנה וד”ר ירון פוקס וחוקרים נוספים מהטכניון בשיתוף עם חוקרים מאוניברסיטת תל אביב, אוניברסיטת מסטריכט שבהולנד ואוניברסיטת גלזגו בסקוטלנד. במימון המחקר תמכו הקרן הלאומית למדע, הקרן הפילנתרופית Schmidt Futures, ושותפות BIRAX ו-Alzheimer Society.
למאמר ב–Nature Communications לחצו כאן



