חוקרים בפקולטה לביולוגיה בטכניון חשפו מנגנון ויסות עצמי מתוחכם המייעל את תהליך בניית החלבונים בגוף
חוקרים בפקולטה לביולוגיה בטכניון חשפו מנגנון ויסות עצמי מתוחכם המייעל את תהליך בניית החלבונים בגוף
להערכת החוקרים, פגיעה במנגנון זה אחראית למצבי חולי רבים

פרופ’ יואב ערבה
חוקרים בפקולטה לביולוגיה בטכניון גילו מנגנון ויסות מתוחכם המייעל את תהליך בניית החלבונים בגוף. להערכתם, פגיעה במנגנון זה מובילה למצבי חולי רבים, ולכן ממצאי המחקר עשויים להוביל להבנה טובה יותר של שיבושים ביולוגיים ולשיפור הטיפול בהם. את המחקר הובילו פרופ’ יואב ערבה והדוקטורנט עפרי לוי.
חלבונים הם מרכיב מרכזי בגוף האדם והם נבנים בריבוזום, בית החרושת התאי. הריבוזום משתמש בשני מרכיבים עיקריים בתהליך בניית החלבון: ה-mRNA (“השליח”), המכיל את המידע הנחוץ לבניית החלבון, וה-tRNA הנושא את חומצות האמינו – חומרי הגלם הדרושים לבניית החלבון.
המחקר שנערך בטכניון התמקד במשפחה ייחודית של אנזימים – אנזימי אמינו-אציל סינטטזות – הממלאים תפקיד חשוב בחיבור נכון של כל חומצת אמינו למולקולת ה- tRNAהמתאימה לה. הדיוק והיעילות של אנזימים אלה קריטיים לאיכות חומרי הגלם המגיעים לריבוזום ולכן גם לאיכותו של החלבון העתידי. תפקידם בתהליך זה נחקר כבר עשרות שנים על ידי קבוצות רבות ברחבי העולם, אולם חוקרי הטכניון גילו תפקיד נוסף של אנזימים אלה שלא היה ידוע עד כה.
הדוקטורנט עפרי לוי
קבוצת המחקר של פרופ’ ערבה גילתה כי בנוסף לחיבור חומצת האמינו ל-tRNA, האנזימים האמורים יודעים לווסת את שכיחותם בהתאם לכמות חומצות האמינו הזמינות. כאשר כמות חומצות האמינו גבוהה ויש צורך בכמות רבה של האנזים, האנזים מפעיל מנגנון שמגביר את ייצורו, וההיפך קורה כאשר אין צורך בכמות גדולה של האנזים. יתרה מכך, החוקרים פענחו את המנגנון המולקולרי שמוציא לפועל פעילות זו: האנזים מתחבר אל מולקולת ה-mRNA “שלו” באיזור דמוי-tRNA ומבקר את זמינותה לריבוזום.
אף שחוקרי הטכניון התמקדו במחקר הנוכחי באנזים אחד ממשפחת האמינו-אציל סינטטזות, הם מעריכים כי מנגנון זה של ויסות עצמי קיים בכל עשרים האנזימים במשפחה זו. מנגנון חכם זה מאפשר למולקולה לווסת את ייצורה לפי צורכי התא, וסביר שהתפתח בשלב מוקדם במהלך האבולוציה.
בשל תפקידם הקריטי של אמינו-אציל סינטטזות בקביעת איכות חומרי הגלם עבור הריבוזום, כל תקלה בפעילותם עלולה להביא לייצור חלבונים מזיקים. ואכן, מוטציות באנזימים אלה מעורבות במחלות רבות באדם. לכן, יתכן שמחקר זה יוביל להבנה טובה יותר של מצבי חולי ולפיתוח דרכים חדשות לטיפול בהם.
המחקר מומן על ידי הקרן הלאומית למדע (ISF), הקרן הדו-לאומית למדע ארה”ב-ישראל ומכון ראסל ברי לננוטכנולוגיה (RBNI).
פרופ’ יואב ערבה השלים תואר ראשון בפקולטה לחקלאות ברחובות, תואר שני ושלישי במחלקה לביוכימיה במכון ויצמן ופוסט-דוקטורט במחלקה לביוכימיה באוניברסיטת סטנפורד. הוא זכה בפרסים רבים ובהם פרס ינאי למצוינות בחינוך האקדמי (2012) ופרס מאני להצטיינות בהוראה (2009). המעבדה בראשותו מתמקדת בחלבונים הנקשרים למולקולות אר-אן-איי ובאפיונים ביוכימייים ומולקולריים של תפקידיהם. לדבריו, “אנחנו משתמשים בשתי מערכות מודל עיקריות: תאי שמרים (שבהם נעשה המחקר המוצג כאן) ותאי עצב. באמצעות יצירת שינויים גנטיים במערכות אלה אנו מנסים להבין את משמעות הקשר בין חלבונים לאר-אן-איי ואת תרומתו לפיזיולוגיה התאית. המאמר הנוכחי הוא דוגמה קלאסית לעבודת המעבדה: זיהינו תופעה של קישור חלבונים למולקולות אר-אן-איי מסויימות, ותוך יצירת שינויים גנטיים הצלחנו לחשוף תפקיד פיזיולוגי חדש ואת המנגנון שעומד בבסיסו.”
למאמר המלא ב– PLOS Biology לחצו כאן
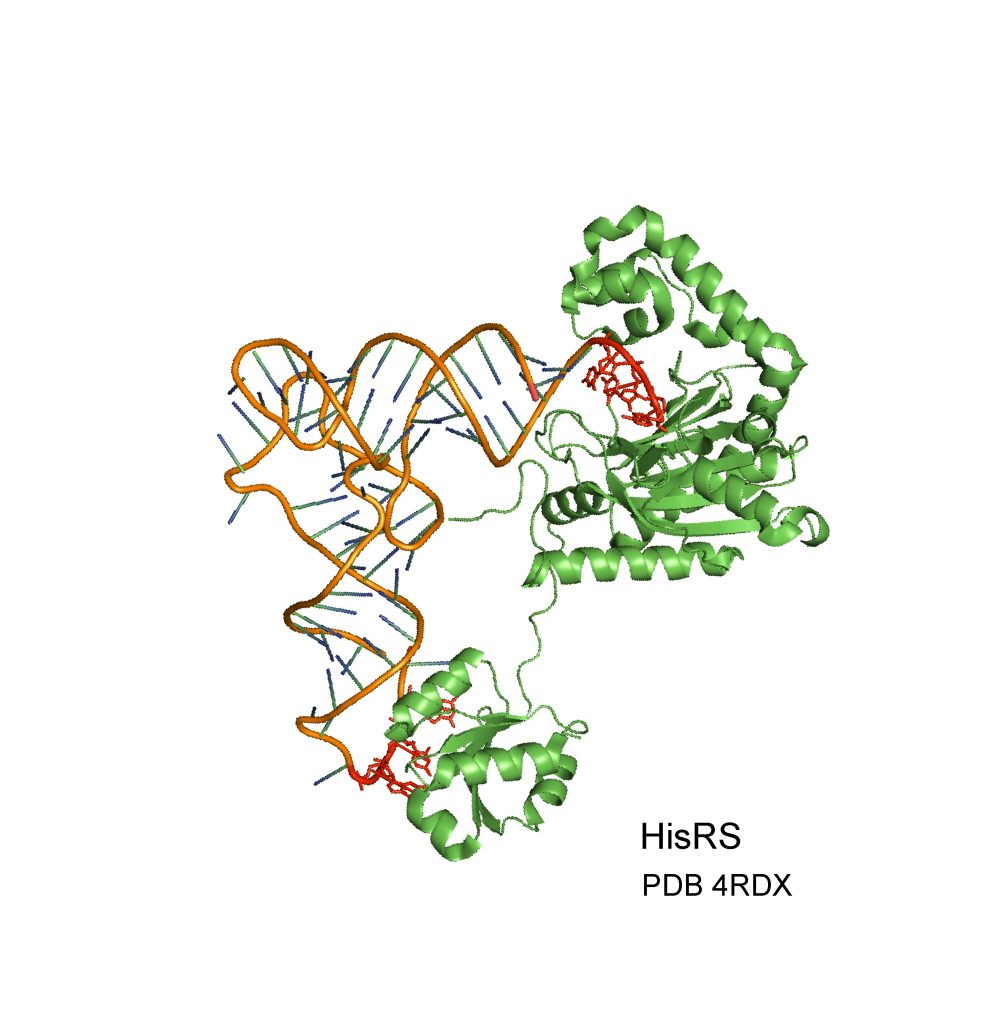
האנזים אמינו-אציל סינטטאז (בירוק) מזהה מולקולת tRNA (חום) ומחבר אליה חומצת אמינו. זיהוי נכון של המולקולה נעשה על פי האיזורים המופיעים כאן באדום. חוקרי הטכניון גילו שהאנזים יודע לזהות גם מולקולת RNA מסוג אחר (mRNA). יתרה מכך, הזיהוי הנכון של ה-mRNA תלוי באזורים הדומים מאוד לאזורי הזיהוי של tRNA (מסומנים כאן באדום).


