“קליע הקסם” של הכימותרפיה
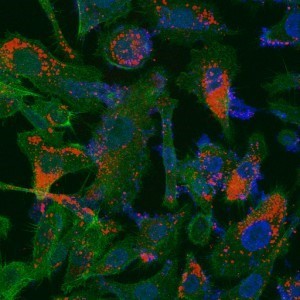
ננו-שלדים (באדום) ששוגרו לרקמת אדם הנגועה בסרטן הערמונית. התאים הנגועים צבועים בתרשים כחול (גרעין) ובירוק (ציטופלזמה), ואפשר לראות כיצד הננו-שלדים מגיעים אליהם
ד”ר בת’ שואן, ילידת פלורידה, מפתחת במסגרת הפוסט-דוקטורט שלה בטכניון פלטפורמה חדשנית להובלה מדויקת של תרופות אנטי-סרטניות.
היא נולדה בעיר הוליווד, פלורידה, סיימה דוקטורט בגיל 26 והגיעה לטכניון ללימודי פוסט-דוקטורט. בשעות הפנאי המעטות שלה היא משחקת כדורגל בקבוצה המובילה בליגת הנשים הארצית – מכבי חדרה – ולומדת עברית אצל מורה פרטי. “העניין הזה עם העברית לא פשוט,” היא אומרת, “אבל אני מוכנה להתאמץ, כי כבר ברור לי שישראל היא המקום שבו אני רוצה לחיות.”
ד”ר בת’ שואן (schoen) השלימה תואר ראשון באוניברסיטת פלורידה, ודוקטורט ב- Michigan State University – שניהם בהנדסה כימית. “בדוקטורט התמקדתי בתחום שנקרא ‘כימיה סינתטית אורגנית’, ובמיוחד בפיתוח פולימרים בעלי תכונות תרמודינמיות ייחודיות – בעיקר עמידות לטמפרטורות גבוהות. חומרים כאלה משמשים בין השאר לייצור חלקים למנועי סילון, שכפצים ונומקס (Nomex, שממנו מייצרים כפפות וסרבלים עמידים לאש). אחת המשימות שלנו היתה לייצר יריעות רכות ולא שבירות, שאפשר ללבוש כהגנה בפני אש או קליעים. זה היה מחקר תיאורטי, אבל במקרים מסוימים גם ייצרתי את הפולימרים האלה ובדקתי אותם.”
לטכניון היא התכוונה להגיע כבר במהלך הדוקטורט, “אבל זה לא הסתדר, ולכן לקראת סיום הדוקטורט התחלתי לגשש כאן היכן אוכל להשתלב.” לבסוף בחרה במעבדה של פרופסור מרסל מחלוף בפקולטה להנדסת ביו-טכנולוגיה ומזון, שכן “ממילא רציתי כבר מזמן לעבור מכימיה לביולוגיה, ויותר מכל רציתי להגיע לתחום של חקר הסרטן. לכן אני שמחה שמרסל נתנה לי צ’אנס – כנראה בזכות הניסיון שלי בננו-חומרים ובפולימרים.”
קבוצת המחקר של פרופסור מחלוף כוללת 17 סטודנטיות ושלושה סטודנטים, והם עובדים על שני פרויקטים עיקריים: (1) יצירת ‘פיגומים’ לשיקום רקמות-לב פגועות, ו(2)פיתוח טכנולוגיה חדשה להחדרת תרופות לרקמות חולות (בעיקר בהקשר האנטי-סרטני). בראיון עמה היא מתמקדת בנושא השני.
“הטיפול הקיים בסרטן משלב הקרנות וכימותרפיה, שפירושה החדרה של תרופות אנטי-סרטניות לגוף, בדרך כלל באמצעות עירוי. התרופות הכימותרפיות הקיימות הן תרופות יעילות מאוד, אבל במתכונת הטיפול הנוכחית יש להן חיסרון עצום: פגיעה בתאים בריאים. מדובר בתרופות רעילות – הרי הן אמורות להרוג את התאים הסרטניים – ולכן הן פוגעות גם ברקמות בריאות.”
הנזק העיקרי נגרם לתאים שמתחלקים מהר, בדומה לתא הסרטני. תאי-שערה, לדוגמה, מתחלקים מהר ולכן נפגעים מתרופות אלה – זו הסיבה לתופעה המוכרת של נשירת שיער בקרב המטופלים בכימותרפיה. תופעות לוואי אחרות הן בחילה ופגיעה בשמיעה, לעיתים עד כדי חירשות. ציספלטין, לדוגמה, היא תרופה כימותרפית המשמשת לטיפול בסוגים מסוימים של סרטן הריאות. תופעת הלוואי שלה היא פגיעה בתיפקוד הכליות ובפעילות המערכת החיסונית, באופן החושף את החולה לזיהומים ומחלות.
לנוכח הבעייתיות האמורה פיתחה פרופסור מחלוף פלטפורמה חדשנית, המאפשרת שיגור של התרופה היישר אל הגידול, מבלי שתפגע ברקמות בריאות. “זו בעצם המטרה העליונה של טיפולים בסרטן: לפתח ‘קליע-קסם’ שיפגע רק בתאים סרטניים,” מסבירה פרופסור מחלוף. “והפלטפורמה שלנו יכולה לתת פתרון לאתגר זה.”
הפלטפורמה החדשנית מבוססת על ‘ריקון’ של תאים ספציפיים – תאי גזע מזנכימליים – כך שלא נותר מהם אלא הקרום (ממברנה). לתוך הקרום הזה, המכונה ‘ננו-שלד’ (nano-ghost), אפשר להכניס כל תרופה שהיא ולשגר אותה בהזרקה ישירות למערכת הדם. מאחר שהמערכת החיסונית הטבעית נופלת בפח ואינה מזהה את ה’תרמית’, היא מתייחסת לתאים האלה כאילו היו חלק ממנה ומשגרת אותם למקום הנגוע. בדרכם לשם הם אינם משחררים את התרופה ולכן אינם פוגעים ברקמות הבריאות. רק בהגיעם לרקמה הממאירה, שאותה הם יודעים לזהות, הם מתפרקים ומחדירים את התרופה לתאי הגידול.
הרעיון המקורי הזה נבדק בשורה ארוכה של ניסויים, והממצאים מרשימים: הננו-שלדים הללו, מתברר, אכן מוכווני-גידול (tumor-selective), ולא חשוב מהו סוג הגידול. הם ‘רצים’ אל הרקמה הממאירה בלי לדלוף בדרך ובלי לפגוע ברקמות הבריאות. יתר על כן, ה’אריזה’ הייחודית מגדילה פי 10 את יעילות הטיפול. בניסויים בחיות מעבדה נמצא כי שימוש בננו-שלדים לשיגור תרופה אנטי-סרטנית הוביל לעיכוב של 80% – שיעור חסר תקדים – של סרטן הערמונית.
ועדיין, העבודה רבה, והחוקרים במעבדה של פרופסור מחלוף עובדים על שיפורו של המנגנון האמור. חלקם מתמקדים בתרופות ספציפיות, וחלקם – כמו בת’ שואן – מתמקדים בשיפור הננו-שלדים. “הפלטפורמה הזאת חייבת להיות מדויקת מאוד,” מסבירה בת’. “היא צריכה להחזיק מעמד לאורך כל הדרך בגוף, ולהיפתח רק בתוך הגידול.”


