הברירה הטבעית: חוקרים בטכניון חשפו מנגנון אבולוציוני המגן על האורגניזם מפני אינטראקציות תוך-תאיות המסכנות אותו. יישום אפשרי: פגיעה ממוקדת בחיידקים עוינים התוקפים את האדם
כתב העת המדעי PNAS מדווח על גילויו של מנגנון אבולוציוני המגן על חיידקים ויצורים אחרים מפני אינטראקציות מולקולריות המסכנות אותם. מנגנון ייחודי זה, שהתגלה על ידי צוות המחקר של פרופ’ נעם אדיר מהטכניון, מגן על כל היצורים החיים על-ידי ניפוי של “רצפים קטלניים” של חומצות אמינו בחלבונים שעתידיים לפגוע באורגניזם. השימוש באינפורמציה על המנגנון יאפשר פגיעה מדויקת בחיידקים מזיקים מבלי לפגוע באדם הנושא אותם.
האבולוציה כידוע היא תהליך שבו מוטציות – שינויים ב-DNA, החומר הגנטי של האורגניזם, משתמרות או נעלמות בהתאם ליתרון ההישרדותי שהן מעניקות לאורגניזם. אורגניזם שיהיה מוצלח יותר – במובן של התאמה לסביבה והעמדת צאצאים פוריים – ייהנה מסיכויים טובים יותר לשרוד ולהוריש את תכונותיו הלאה לדורות הבאים. ראוי לציין בהקשר זה כי הביטוי “החזק שורד” אינו ניסוח מדעי נכון, שכן הפרט החזק יותר אינו בהכרח הפרט המתאים יותר לסביבה. הניסוח הנכון, כפי שנטבע על ידי צ’רלס דרווין, הוא “הישרדותם של המתאימים ביותר” (survival of the fittest).
בתהליך הברירה הטבעית, שהוא אחד מעקרונות היסוד של האבולוציה, חשופים הפרטים המתחרים ללחץ אבולוציוני, שהוא מכלול הגורמים המשפיעים על התאמתו של הפרט לסביבה: עמידוּת למחלות, לטורפים, לאתגרים אקלימיים וכו’ ויכולת להעמיד צאצאים פוריים שישרדו ויעבירו הלאה את אותן תכונות-תואמות-סביבה.
שיטה חדשנית
המחקר המתפרסם ב- PNAS נערך על ידי פרופ’ אדיר, חבר סגל בפקולטה לכימיה ע”ש שוליך בטכניון, יחד עם ד”ר שרון פניאס-נבון והמסטרנטית טלי שוורצמן מקבוצת המחקר שלו. החוקרים נעזרו בשיטה חדשנית לזיהוי URSs – underrepresented sequences, כלומר רצפים חסרים או נדירים, מתוך מאגר המידע העצום של מידע ביולוגי. לאחר זיהויים של רצפים אלה בשיטה הם בחנו, באופן ניסויי, את השפעתם של URSs על חיידקים. המסקנה: נדירותם של רצפים ספציפיים בחיידק ספציפי נגזרת מהנזק הפוטנציאלי של רצפים אלה, העלולים לעכב את יצירת החלבונים (סינתזה) ולבלום את התפתחותו של החיידק. במילים אחרות, הלחץ האבולוציוני מפחית, לאורך זמן, את שכיחותם של “רצפים קטלניים” המאיימים על חוסנו של החיידק.
“המכונות המולקולריות המאפשרות את קיום החיים,” מסביר פרופ’ אדיר, “הן פולימרים ארוכים הבנויים מרצפים ליניאריים של קבוצות כימיות שונות: חלבונים, DNA ו-RNA. השונוּת המדהימה המאפיינת את העולם הביולוגי היא תולדה של השינויים האבולוציוניים החלים בפולימרים אלו.”
ברמה המולקולרית נובעת שונות זו בעיקר מהמספר האסטרונומי של אפשרויות שונות לסידור של חומצות האמינו הטבעיות מהן בנויים החלבונים. מספר זה נגזר מקיומן של 20 חומצות אמינו טבעיות; שימוש בשלוש מהן בלבד מוביל ל-8,000 רצפים אפשריים שונים, שימוש בחמש מאפשר יותר מ-3 מיליון רצפים שונים, וכן הלאה. בחלבון טיפוסי אין שלוש או חמש חומצות אמינו אלא מאות. “רצף חומצות האמינו קובע את המבנה התלת ממדי של החלבון ומכאן את מאפייניו ויכולותיו. היקשרות החלבון לחלבונים אחרים עשויה ליצור יכולות חדשות ומשופרות, אך חיבור שגוי עלול לפגוע בחלבון ואף להוביל למותו של התא, כלומר של החיידק.”
חיבורים שגויים כאלה יכולים לנבוע מהיווצרותן האקראית של מוטציות “שליליות”, כלומר כאלה שלא צפויות לשרוד משום שהן מקטינות כושר ההישרדות של האורגניזם לסביבה. כאן נכנסת לתמונה אחת המהפכות המדעיות החשובות של השנים האחרונות – הביו-אינפורמטיקה, במסגרתה נצבר מידע עצום על רצפי DNA של אורגניזמים שלמים – מחיידקים פשוטים ועד לאדם. “המחקר הנוכחי נבע מן ההבנה שמאגר מידע זה מספק לנו הזדמנות לבדוק לא רק את הרצפים הנפוצים באורגניזמים שונים, כפי שעושות קבוצות מחקר רבות בעולם, אלא גם את ה- URSs – הרצפים החסרים והנדירים.”
לשם כך כתבו החוקרים תכנית מחשב הסורקת את כל הרצפים המקוּדָדים לכל החלבונים האפשריים (הפרוטאומים) בגנום של מיקרואורגניזמים שונים, בעיקר פתוגניים (מחוללי מחלות). המטרה: איתור URSs באורגניזמים ספציפיים. פרופיל ה- URSsמשתנה מחיידק לחיידק, ובשלב זה של המחקר התמקדו החוקרים בחיידקי E. coli.
הניסוי: השתלת רצפים נדירים
כעת ביקשו החוקרים להוכיח שה-URSs אכן מזיקים (ומכאן נדירותם) ולקבוע את מקום פגיעתם המדויק. לשם כך הם השתילו את רצפי ה-URS האלה בתוך חלבונים רגילים. התוצאה, שאותה אפשר לראות בצד הימני של התרשים המצורף: השתלת ה- URSsפגעה בתהליך הסינתיזה של חלבונים חדשים. יתר על כן, כאשר השתמשו ברצפי URS ארוכים יותר – רצף של 4 חומצות אמינו – הובילה הנוכחות של רצף ה-URS לעיכוב התפתחות החיידק ואף למותו.
צירופן של חומצות האמינו ליצירת חלבון חדש מבוצע על ידי הריבוזום, המקבל את ההוראות מהקוד הגנטי. לפיכך פנו החוקרים למומחים המתמחים במדידת פעילותם של ריבוזומים בודדים: פרופ’ ג’וזף פוגליסי (Puglisi) מאוניברסיטת סטנפורד והדוקטורנט שלו, גיא קורנברג. פוגליסי וקורנברג השתילו גם הם את רצפי ה- URSsבחלבון ואישרו את הממצאים: רצפים אלה אכן מעכבים את תהליך התרגום ואת התפתחות החלבון. יתר על כן, הם קבעו במדויק באיזה מקום בריבוזום מתרחש העיכוב בתהליך התרגום: בכניסה לתעלת היציאה של הריבוזום, ממנה “בוקעים” החלבונים החדשים.
קבוצת המחקר בטכניון אף השתילה את אותם רצפים בחלבון בתרבית של תאים אנושיים, והתוצאה: לא ניכרה שום השפעה על החלבון, כלומר לא נגרם שום נזק לאדם. “הממצאים האלה,” אומר פרופ’ אדיר, “מבהירים ששימוש ב-URSs עשוי לפגוע באופן ממוקד בחיידקים שאנחנו רוצים ברעתם, וזאת בלי לפגוע באדם שבגופו הם נמצאים. לאור זאת, ובתקווה שבעתיד הקרוב ייבדקו האפשרויות היישומיות של התגלית שלנו, רשמנו עליה פטנט יחד עם הטכניון.”
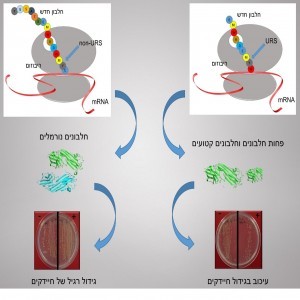
בתרשים: URSs, כאמור, מעכבים תרגום חלבונים ועלולים להיות קטלניים לתא ולאורגניזם כולו. חלקו הימני של התרשים מציג את “מנגנון הנזק” שלהם, וחלקו השמאלי של התרשים מציג תהליך נורמלי ותקין בהעדרם של URSs.למעלה: המידע הגנטי, המקודד את רצף חומצות האמינו, מגיע לריבוזום בעזרת מולקולה הקרויה mRNA. חומצות אמינו (עיגולים צבעוניים) מצטרפות לכדי רצף והחלבון החדש נדחף החוצה מתעלת היציאה של הריבוזום. בצד שמאל נראה רצף רגיל היוצר חלבונים נורמליים ואילו בצד ימין מכילה שורת חומצות האמינו את ה-URS החזק CMYW (בחיידקי E. coli), הבולם את החלבון בדרכו החוצה וכך מונע תרגום של חלבונים נוספים. באמצע: בצד שמאל מתארגנים החלבונים בצברים נורמליים, ואילו בצד ימין – בהשפעת ה-URS – מתורגמים פחות חלבונים תקינים ונוצרים חלבונים פגומים שלא תורגמו עד הסוף. למטה: תאים של החיידק E. coli גדלים על צלחות בנוכחותו (+) או בהעדרו (-) של IPTG – חומר הגורם לתרגום חלבונים. משמאל, כלומר בצד התקין שבו החלבון המתורגם (+) אינו מכיל URS, מספר מושבות החיידקים זהה למספר מושבות החיידקים שגדלו ללא פקודת תרגום (-). מימין, בצד המשובש שבו החלבון המתורגם מכיל URS (+), מספר המושבות קטן בהרבה ממספר המושבות שגדלו ללא פקודת התרגום (-).





